La empresa a cargo del desarrollo realizó la validación en el Laboratorio Central de Córdoba y el test ya está a la venta a través de una plataforma web en un contexto de máxima discreción.
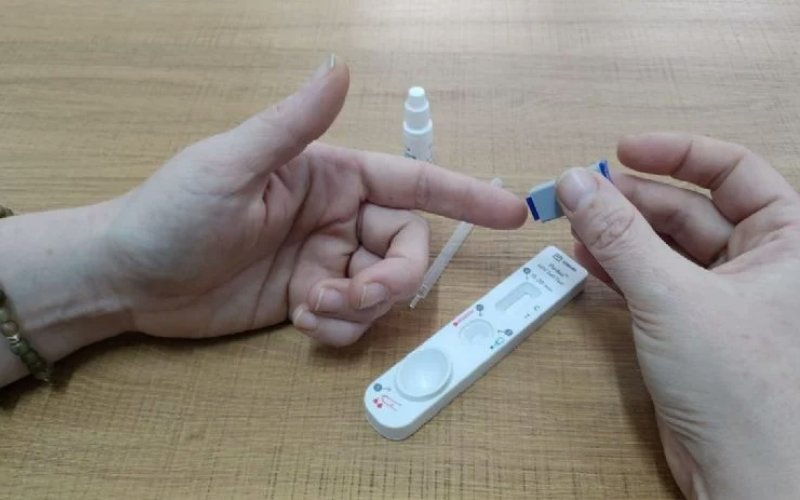
Una empresa privada desarrolló un dispositivo para realizarse un autotest de VIH y logró la validación del Laboratorio Central de la provincia de Córdoba para poder comercializarlo a través de la plataforma web “Mitest”.
El organismo provincial, referente en la materia a nivel nacional en el diagnóstico y seguimiento de las personas que viven con VIH, fue pionero en estrategias de descentralización y ampliación diagnóstica.
Es por eso que acompañó el desarrollo de este autotest y su aprobación en Argentina significan un paso más para sumar acceso, ya que no solo se facilita la adquisición de estas pruebas, sino que también resuelven demandas específicas de diagnóstico de VIH, en un contexto de máxima discreción.
Además, tienen la potencialidad de aumentar la aceptación de testearse a personas que por distintos motivos no se acercan a los estamentos públicos para comprobar si adquirieron la infección, a pesar de estar expuestas a alto riesgo.
Cómo funciona
Durante diciembre de 2023 y enero de 2024, el Laboratorio Central de la Provincia de Córdoba llevó a cabo dos estudios para validar un autotest de VIH desarrollado por una empresa privada, que ya se comercializa en Argentina. Los informes fueron presentados ante ANMAT en el marco del proceso regulatorio de aprobación.
Se trata de PanBio, desarrollado por Drofar y Abbott, y destinado a ser autoadministrado por usuarios no profesionales (se vende a través del portal web Mitest), y de CheckNow, la misma prueba, para su uso en salud pública.
Ambos kits utilizan una muestra de sangre capilar, obtenida de una punción digital (del dedo anular, mayor o índice) que solo requiere de tres componentes: el dispositivo de prueba, una lanceta para la punción y una solución buffer.
Para evaluar estas pruebas, se diseñaron estudios paralelos con un doble objetivo: por un lado, medir la sensibilidad y especificidad de los kits; y por el otro, observar su usabilidad en usuarios sin entrenamiento. Las pruebas fueron evaluadas tanto por usuarios profesionales como por usuarios no profesionales.
El proceso de validación
En primer lugar, se realizó una ronda de pruebas con muestras congeladas de suero almacenadas de manera anónima no vinculante, previamente caracterizadas, tanto con el kit en estudio como con el método de referencia.
Se analizaron 70 muestras positivas, que fueron correctamente identificadas por ambos reactivos (CheckNow y PanBio), y 105 muestras negativas, entre las cuales hubo un solo resultado de falso positivo para ambas pruebas. Esto implica una sensibilidad del 100% y una especificidad del 99.05% para cada una.
Luego, se invitó a 40 personas no profesionales a probar el autotest, previa explicación de la finalidad del estudio, riesgos y beneficios. Cabe señalar que, además del kit, los participantes pudieron acceder a una prueba de test rápido convencional realizada por el Laboratorio Central, para que pudieran retirarse con un diagnóstico confirmado por ambos métodos.
Los participantes realizaron el análisis de acuerdo a las instrucciones contenidas en el dispositivo, con un profesional del equipo de investigación como observador, que supervisó las pruebas y la interpretación de los resultados. Aún así, no ayudó a los voluntarios. Los usuarios completaron además un cuestionario de 30 preguntas, para evaluar aceptabilidad, fidelidad y usabilidad del dispositivo.
Además, los resultados válidos se correlacionaron con los obtenidos por la prueba de VIH realizada por profesionales. Solo se obtuvo una prueba no válida en los test destinados a su uso en salud pública. El estudio concluyó que las pruebas eran fáciles de usar, seguros y confiables para personas no profesionales.












